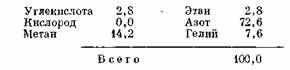|
Основными
газообразными примесями в природном газе являются азот, углекислота и
сероводород; эти газы называются инертными. Гелий относится к примесям,
содержащимся в относительно небольших количествах, однако имеет большое
практическое значение.
Присутствие в природном газе
относительно больших количеств углекислоты и азота снижает его
воспламеняемость и тем самым уменьшает его теплотворную способность. Эти же
примеси повышают температуру горения природного газа. Предел воспламеняемости
пропанового газа достигается при весовом отношении углекислоты к пропану
около 8:1, а азота к пропану- около 15:1. Для бутана предел воспламеняемости
наступает при достижении весовых отношений примерно 9:1 для углекислоты и
16:1 для азота. Природные газы, содержащие при высоких давлениях столь
большое количество углекислоты и азота, что становятся невоспламеняемыми,
иногда используются вместо пара в паровых машинах на нефтепромыслах.
Негорючие природные газы известны как «воздушные» газы.
Гелий. Гелий (Не) представляет собой легкий,
бесцветный, не имеющий запаха, химически инертный элемент [93], в условиях
нормального давления и температуры существующий в газообразной фазе. Это один
из инертных газов (гелий, неон, аргон, криптон, ксенон и радон). Впервые он
был обнаружен в 1868 г. в виде неопознанной желтой линии в спектре Солнца;
на Земле в качестве самостоятельного элемента гелий был открыт в 1895 г. Он содержится в атмосфере (5 ч. на млн. по объему), в некоторых урановых минералах и в газах
(объемы которых поддаются измерению) некоторых рудников, фумарол и источников
минеральных вод; в значительно больших количествах гелий встречается в
природных газах, достигая в некоторых из них 8 об. %.
Проблема происхождения столь больших количеств гелия, этого химически
инертного элемента, в месторождениях природного газа все еще не решена.
Выделение гелия при распаде таких радиоактивных элементов, как уран, радий и
торий, приводит к предположению, что первичным источником гелия является
радиоактивность. Ионы гелия испускаются в виде положительных частиц с двойным
зарядом, ядром которых служат альфа-частицы. Для заданного количества
радиоактивного элемента можно рассчитать скорость излучения этих
альфа-частиц, что позволяет произвести подсчет количества гелия, образующегося
таким способом за определенный промежуток времени. И наоборот, «гелиевым
методом» можно измерять геологический (абсолютный) возраст пород. Скорость
выделения гелия различными радиоактивными элементами приводится в табл. 5-21.
Взяв за основу величину среднего содержания радиоактивных веществ в породах
земной коры, Роджерс подсчитал, что ежегодно в них образуется от 282 до 1060
млн. куб. футов гелия [94].
Скорость выделения гелия
различными радиоактивными элементами

Как показал Уэлс, при умеренных температурах ‑ от 200 до 500°С ‑
проницаемость богатых кремнеземом изверженных пород для гелия значительно
выше, чем для других газов [95]. Отсюда следует, что большая часть
содержащегося в осадках гелия, вероятно, образовалась в результате
радиоактивного распада в изверженных породах, залегающих на небольших
глубинах под гелиеносными осадочными толщами. Примечательно, что
радиоактивные эманации очень хорошо растворяются в нефтях. Бойль [96]
установил, что растворимость эманации радия в очищенной нефти в 50 раз выше,
чем в воде; гелий же, будучи нерастворим в нефтях, мог выделяться из них,
причем его улетучивание, видимо, происходит почти с той же скоростью, что и
образование.
Поскольку нет убедительных доказательств, что весь гелий
образовался в результате распада радиоактивных веществ, многие
исследователи считают, что значительные количества его, известные в земной
коре, имеют изначальное происхождение. В газах, содержащих гелий, обычной
акцессорной примесью является также азот; происхождение высоких содержаний
азота в гелиеносных природных газах, так же как и происхождение самого гелия,
можно рассматривать как изначальное (об азоте см. ниже).
Единственной страной, имевшей месторождения природного
газа с содержанием гелия, рентабельным для промышленной утилизации, до сих
пор были Соединенные Штаты Америки. Содержание гелия в этих месторождениях
колеблется в пределах 1-8 об. % [97]. Возможно, однако, что залежи
гелиеносных газов открыты в настоящее время и в других странах.
Гелиеносный газ, обнаруженный в породах
формации Урей (миссисипий и девон) на нефтегазовом месторождении Раттлснейк,
Нью-Мексико, отличается необычно высоким содержанием азота [98]. Данные
анализа показали следующий состав этого газа (в %):
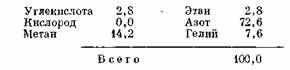
Азот. Азот (N2)
- бесцветный, не обладающий вкусом и запахом газ, составляющий 78% сухого
воздуха. Он входит в состав природного газа в количестве до 99 об. % и
рудничного газа, который иногда нацело состоит из азота. Азот отмечается
среди изверженных пород, в газах минеральных источников и гейзеров, в
фумарольиых газах; кроме того, он растворен в морской и пресной воде, а также
в пластовых водах. Имеются по крайней мере два возможных источника, откуда
азот мог поступить в природный газ. Высокое процентное содержание азота в атмосфере
и общая химическая инертность этого элемента позволяют считать, что азот,
входящий в состав природного газа, улавливался осадками из воздуха в процессе
седиментации. Дополнительными источниками этого газа, вероятно, служили
извержения и разложение содержащих азот органических соединений. Отсутствие же
в природном газе кислорода, видимо, связано с его удалением в результате
окисления минералов осадочных пород. На существование второго источника азота
указывает высокое содержание этого элемента в газах, обогащенных гелием.
Весьма вероятно, что в таких случаях и азот, и гелий имеют общее
происхождение. Например, Гослин [99] установил, что при добавлении радия в
сосуд, где находятся вода, рыбы, водные растения и почва, наблюдается быстрое
выделение азота из животных и растительных белков. Высокое содержание
свободного азота в природных газах не определяется количеством химически
связанного азота, "входящего в состав нефти и других нафтидов данной
залежи. Богатые азотом газы встречаются совместно с нефтями, бедными азотистыми
соединениями, и наоборот.
Значительные примеси азота весьма обычны для многих
газовых залежей регионов Мид-Континента и Скалистых гор, где его содержание
колеблется от 5-10 почти до 100% . Например, газ из месторождения Уэстбрук в
округе Митчелл, Техас, на 85-95% состоит из азота. Но поскольку содержание
азота в атмосфере достаточно велико, практическое использование этого газа из
залежей крайне ограничено.
Углекислый газ. Углекислый газ (СО2)
- бесцветный, не горючий, не обладающий запахом газ, в полтора раза тяжелее
воздуха. Он легко растворим в воде; при нормальных температуре и давлении в
единице объема воды растворяется такой же объем углекислого газа. В условиях
земной поверхности углекислый газ инертен, при концентрации его свыше 8% он токсичен
и вызывает обморочное состояние. В природе углекислый газ образуется при
воздействии кислот на карбонаты и бикарбонаты, входящие в состав изверженных,
осадочных и метаморфических пород; при окислении углеводородов на контакте их
с минерализованными водами; при нагревании карбонатов и бикарбонатов, а также
под влиянием определенных видов анаэробных бактерий, разлагающих
углеводороды. В количестве 0,03 об. % углекислый газ входит в состав атмосферного
воздуха. Различные количества его отмечаются во всех типах изверженных,
метаморфических и осадочных пород. Огромные объемы углекислого газа поступают
в атмосферу с вулканическими эманациями. В растворенном виде он присутствует
в пресной и океанической воде, а также в водах минеральных источников. Залежи
природного газа, обогащенного углекислым газом, распространены по преимуществу
в западных штатах - Монтане, Колорадо, Юте и Нью-Мексико,- а на месторождении
Норт-Парк в Колорадо углекислый газ получают из скважин вместе с нефтью.
Некоторые залежи природного газа в Калифорнии содержат до 49% углекислого
газа. Наивысшие известные его концентрации отмечаются в залежах Нью-Мексико,
где углекислый газ составляет в некоторых случаях 99% и более всего объема
газа в залежи. Некоторые скважины здесь могут дать от 12 до 26 млн. куб.
футов углекислого газа.
Полагают, что крупные залежи углекислого газа в штате
Нью-Мексико и в Мексике образовались в результате вулканических эманации, а
частично и в результате выделения углекислого газа при термическом
воздействии изверженных пород на контакте их с известняками; подобное же
выделение углекислого газа происходит в печах для обжига извести. Огромное
большинство залежей Нью-Мексико, обогащенных углекислым газом, находится на
расстоянии не свыше нескольких миль от районов, характеризовавшихся в
недавнем прошлом высокой вулканической активностью [100]. Причину высокого
содержания углекислого газа в некоторых залежах Калифорнии усматривают в
окислении углеводородов при их контактировании с минерализованными водами
[101].
Интересно отметить, что когда скважина дает углекислый
газ, то внезапное расширение его в стволе вызывает резкое охлаждение труб,
бурового инструмента и оборудования на устье до очень низких температур.
Например, на месторождении Мак-Каллем в округе Джэксон, Колорадо, в составе
газа которого содержится 92% углекислого газа, трубы и резервуары даже в
самый жаркий день покрываются толстым слоем льда или снега [102].
Теплотворная способность этого газа ‑ 677
британских тепловых единиц, он добывается вместе с нефтью, которая обладает
плотностью 35,3°API, и содержит 1,33% серы. Обычно же
теплотворная способность природного газа в среднем составляет 1075 британских
тепловых единиц на 1000 куб. футов.
Сероводород. Сероводород (H2S) ‑ бесцветный газ с характерным неприятным запахом;
хорошо растворим в воде и, как правило, еще лучше в углеводородах. В единице
объема воды при 0°С и давлении 1 атм растворяется 4,3 таких же
объемных единиц сероводорода. Сероводород, как в виде свободного газа, так и
будучи растворенным в нефти или пластовой воде, является активным агентом
коррозии металлов. Он токсичен даже в небольших концентрациях: содержание
0,005% этого газа вызывает довольно острое отравление при воздействии на
дыхательные пути в течение длительного времени, концентрации в 0,06-0,08% в
опытах с собаками вызывали немедленное их отравление (прекращалось дыхание,
сердце переставало работать и наступала смерть) [103]. Природные газы,
содержащие даже небольшое количество сероводорода, непригодны для сжигания в
местах, где присутствует человек. В связи с этим в ряде штатов приняты
законы, по которым запрещается употребление газа, не очищенного от
сероводорода, если содержание последнего превышает 20-30 гран на 100 куб.футов
газа [104]. При добыче природного газа, нефти или пластовой воды, обогащенных
сероводородом, возникают следующие проблемы: 1) обеспечение безопасности
людей, 2) предохранение оборудования от коррозии и 3) обработка нефти или
газа в целях удаления сероводорода.
Хотя сероводород выделяется при вулканических
извержениях, присутствует в газах некоторых минеральных источников и
образуется при разложении органического вещества растительного или животного
происхождения, можно полагать, что тот сероводород, который входит в состав
природного газа и растворен в нефти, образовывался органическим или
неорганическим путем при восстановлении сульфатов до сульфидов. В
солоноватоводных и застойных водоемах, в которых не содержится растворенного
кислорода, бактерии воздействуют на соли, имеющие в своем составе химически
связанный кислород, в том числе и на сульфаты, входящие в органическое
вещество, извлеченные из выветрелых минералов или растворенные в воде. Из
илов солоноватоводных озер были выделены различные микроорганизмы, способные
образовывать сероводород при восстановлении сульфатов до сульфидов.
Сульфат-редуцирующие бактерии обнаружены также в растительном перегное,
буровом растворе, в придонных водах внутренних морей, в озерных осадках, в
кернах неглубоких скважин и в воде некоторых скважин, дающих нефть. Для
развития подобных бактерий наиболее благоприятны температуры от 25 до 50°С.
Механизм образования сероводорода неорганическим путем
в результате восстановления сульфатов можно представить уравнением
2C + MeSО4 + H2О → MeCО3 + CО2
+ H2S,
где Me ‑
металл, а С ‑ углерод, входящий в состав органического вещества. По
вопросу о том, какой из двух способов образования сероводорода ‑
органический или неорганический ‑ преобладает, развернулась широкая
дискуссия. Однако в настоящее время большинство исследователей склонно
считать, что основным все же является бактериальный путь.
Природный газ, содержащий значительное количество
сероводорода, обнаружен во многих районах [105]; наиболее известные среди
них: район Панхандл в Техасе; западный Техас; юго-восток Нью-Мексико (где
газовые залежи приурочены к пермским и пенсильванским отложениям); район
Тампико-Такспан в Мексике (где с высоким содержанием H2S и СО2 в газе связано много несчастных
случаев); соляные купола провинции Галф-Кост в Техасе и Луизиане и нефтяные
месторождения Ирана. Присутствие в разрезах провинции Галф-Кост и Ирана
большого количества гипсов указывает на образование сероводорода в результате
восстановления сульфатов под влиянием битуминозных веществ.
Исключительно высокое содержание сероводорода в
природном газе обнаружено в восточном Техасе, Арканзасе и Вайоминге. Приводим
данные анализов (в %) подобного газа, полученного близ Эмори в
северо-восточном Техасе [106].

Теплотворная способность этого газа 956 британских
тепловых единиц на 1000 куб. футов. Его удельный вес по воздуху 0,973.
При промышленной переработке из 1 млн. куб. футов газа может быть получено 15
т серы.
Газ, растворенный в нефти, которая добывается из
эоценовых мергелей на месторождении Месджеде-Солейман в Иране, содержит 40%
сероводорода [107].
|